В научной среде валентностью химических элементов принято называть способность атомов образовывать определённое количество связей. Этот термин неоднократно подвергался изменениям, что связано с развитием теории химической связи. Общее количество атомов у одного и того же элемента отличается. Итоговое значение должно находиться в пределах от I до VIII.

Понятие валентности
Впервые понятие о валентности было введено в химию задолго до того, как учёные смогли определить строение атома. Этот термин в 1853 году предложил использовать английский химик Франкленд. Сегодня науке достоверно известно, что численная характеристика элементов связана с общим количеством внешних электронов атомов. Это обусловлено тем, что электроны внутренних оболочек не принимают участия в образовании химических связей.
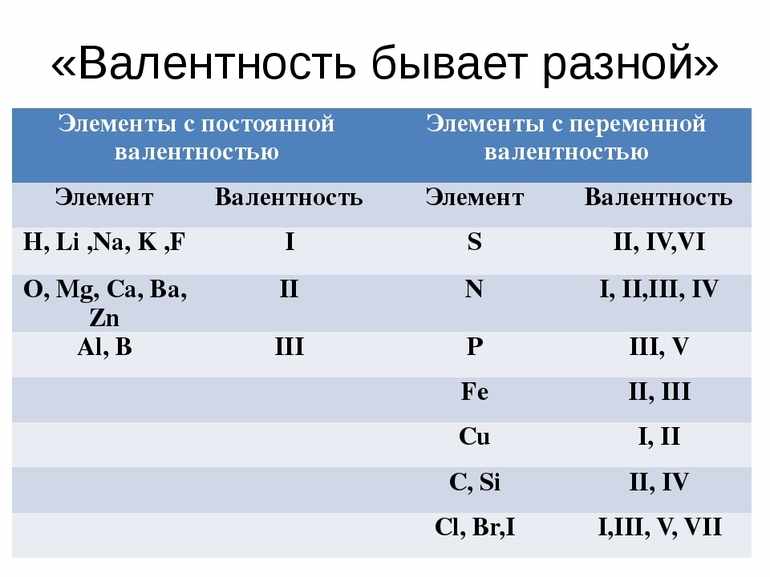
Немногие элементы обладают постоянной численной характеристикой. Например, калий и натрий во всех соединениях остаются одновалентными. К категории двухвалентных элементов относятся:
- Магний.
- Кальций.
- Цинк.
Трёхвалентным является алюминий. Многие вещества проявляют переменное значение, так как всё зависит от условий протекания химической реакции. В сочетании с хлоридом железо может образовывать сразу два соединения — FeCl3, FeCl2. Валентность железа будет равна III и II соответственно. Численная характеристика перманганат калия (KMnO4) — VII, углекислый газ (СО2) — IV, оксид серы (SO3, SO2) — VI.
Степень окисления является сложным понятием, которое характеризует состояние элемента в химическом соединении. Дополнительно можно проследить за окислительно-восстановительной реакцией. Значение окисления будет соответствовать формальному заряду, который также можно приписать элементу, руководствуясь тем, что все электроны перешли к более электроотрицательному атому. Но и в этом случае есть свои нюансы.
Нужно разбираться в общих тенденциях изменения электроотрицательности. В любом элементе атом стремится заполучить устойчивую конфигурацию внешнего электронного слоя (октетная оболочка инертного газа). За счёт этого электроотрицательность химических элементов в периоде будет увеличена. Для лучшего понимания этого правила следует рассмотреть пример. Сера (S) будет более электроотрицательна, нежели фосфор (Р) и кремний (Si). Окислительное число принято обозначать арабской цифрой.
Применение формул
В таблице валентности можно посмотреть значение любого химического вещества. Это самый простой вариант, так как не нужно проводить никаких математических расчётов. Численной характеристикой водорода является единица, так как это вещество может связываться с другими атомами. В остальных случаях используемое число указывает на то, какое именно количество атомов водорода можно присоединить в конкретном случае.

К примеру, валентностью Н в молекуле HCl является единица. В этом случае использование индекса не предусмотрено, так как численная характеристика водорода и хлора равна единице. Эти химические вещества относятся к разряду одновалентных элементов.
Но также можно рассмотреть другой пример. Валентность C в CH4 — IV, а H — I. Поэтому вместе с водородом нужно указать цифру 4. Формулу метана можно записать так: СН4. Многие элементы отлично взаимодействуют с кислородом, который при любых условиях остаётся двухвалентным. Именно поэтому в формуле Н2О, в которой присутствует одновалентный водород и двухвалентный кислород, рядом с Н указан индекс 2. С помощью такой записи можно показать, что молекула воды включает в себя 2 атома водорода и всего 1 атом кислорода.
Примеры решения задач
Для корректного определения валентности и степени окисления химических элементов нужно руководствоваться правилами электронейтральности. Благодаря изучению примеров можно повысить уровень знаний по этой теме.
Задача № 1. Нужно рассчитать окислительное число веществ, которые присутствуют в соединении N205. Больше всего притягивает к себе электронные пары атом кислорода, степень окисления которого составляет -2. Атом N2 обладает значением +5. Итоговая сумма степеней окисления будет близка к нулю. Принцип решения этой задачи выглядит следующим образом: 2*(+5) + 5*(-2) = 0.

Задача № 2. Предстоит узнать окислительное число всех веществ, которые участвуют в соединении K2Cr2O7. Калий расположен в первой группе главной подгруппы. Показатель его окисления составляет +1. Cr относится к VI побочной подгруппе, из-за чего у него переменная валентность, которую нужно рассчитать. Окислительное число кислорода равно -2. Для поиска правильного ответа числовую характеристику серы можно обозначить как х. Нужно учесть, что нулю будет соответствовать сумма окисления. Формула будет выглядеть так: 2*(+1) + 2*х + 7 (-2) = 0. Получается, что х = +6.
Задача № 3. Нужно узнать степень окисления соединения Na2SO4. Максимальная валентность Na составляет +1. Этот химический элемент относится к первой группе. Окислительное число кислорода -2. Сера является элементом VI группы, из-за чего используется переменное значение.
Если нужно указать валентность серы в первом возбуждённом состоянии, тогда обозначить это вещество можно как х. Нулю будет равна итоговая сумма окисления. Если учесть количество атомов каждого элемента, тогда можно будет получить следующее уравнение: 2*(+1) + х + 4 (-2) = о. Ответ: х = +6.
Ключевые нюансы
О валентности уместно говорить только в том случае, если речь касается элементов молекулярной природы. Это понятие не может быть задействовано для описания химических связей в соединениях ионного, кластерного, а также кристаллического типа. Нужно запомнить, что в элементе молекулярной природы конечное число валентностей обоих веществ будет равно. Лучше всего использовать наименьшее кратное. Например:

- Если по условиям задачи есть химическая формула Mn2O7 и достоверно известна валентность кислорода, тогда можно легко определить, что наименьшим общим кратным будет — 14. Из этого получается, что валентность Mn — VII.
- Если нужно правильно записать формулу оксида фосфора, тогда следует учесть, что численная характеристика фосфора V, а кислорода — II. Наименьшим общим кратным для Р и О будет 10. Формулу можно записать следующим образом: Р2О5.
Понимание принципов валентности помогает не только решать сложные задачи, но и проводить различные опыты, в том числе на уроках химии.