Первое место среди известных металлов, находящихся в земной коре, занимает тринадцатый элемент в периодической таблице Менделеева — алюминий. Строение атома позволяет элементу обладать высокой электропроводностью и пластичностью. До момента открытия промышленного способа создания вещества оно стоило дороже золота. Из-за высокой сопротивляемости коррозии и низкого веса металл нашёл широкое применение в строительстве, быту, электрике и даже фармацевтике.

Физические и химические свойства
Процесс получения алюминия несложен. Современный способ разработал американский учёный Чарльз Холл. Что интересно, немного позже этот метод использовал французский химик Поль Эру, незнакомый с исследованиями американца. Суть создания алюминия заключается в растворении оксидированного алюминия в растворе криолита. Затем в жидкость погружают графические электроды. Недостаток метода заключается в больших затратах электроэнергии, поэтому активно он начал использоваться только в начале двадцатого века.

К полезным свойствам алюминия относят его небольшую плотность — она втрое меньше, чем у железа и меди. Материал характеризуется довольно хорошей прочностью, имеет коррозийную стойкость и неплохую теплопроводность. Из-за своих характеристик он нашёл широкое применение как технический материал.
Отсутствие вредных примесей для человеческого организма в веществе, податливость к штамповке и лёгкость позволили применять элемент при изготовлении промышленной и бытовой фольги, кухонной посуды.
В природе алюминий содержится только в минералах.
Его можно извлечь из следующих соединений:

- Гидроокисла — Al2O3 * H20. Бокситы представляют собой глиноподобную массу. Это одна из наиболее важных руд алюминия.
- Алюмосиликата калия и натрия — (Na, K) AlSiO4. Породообразующий материал (элеолит) с шестиугольной кристаллической системой.
- Квасцового камня — KAl3 (SO4)2 (OH)6. Алунит образовывается при воздействии сернокислых вод с силикатами, что создаёт окись алюминия.
- Корунда — Al2O3. Кристаллический глинозём с высокой твёрдостью.
- Силиката — Al2O3. Породообразующий материал, содержащий порядка 19% оксида алюминия в своём составе.
Кроме этого, элемент можно извлечь из каолина, известняка, магнезита. В химических реакция вещество проявляет себя как восстановитель. С галогенами при температуре 20−24 градуса по Цельсию он образовывает галогениды: 2Al + 3Cl2 = 2AlCl3. С другими веществами создаёт бинарные соединения. Например, Al + P = AlP, 4Al + 3C = Al4C3, 2Al+ 3F2 = 2AlF3. При взаимодействии этих соединений с водой образуются гидроксиды и летучие водородные соединения.
С металлами формирует сплавы с интерметаллическими соединениями.
Электронная конфигурация
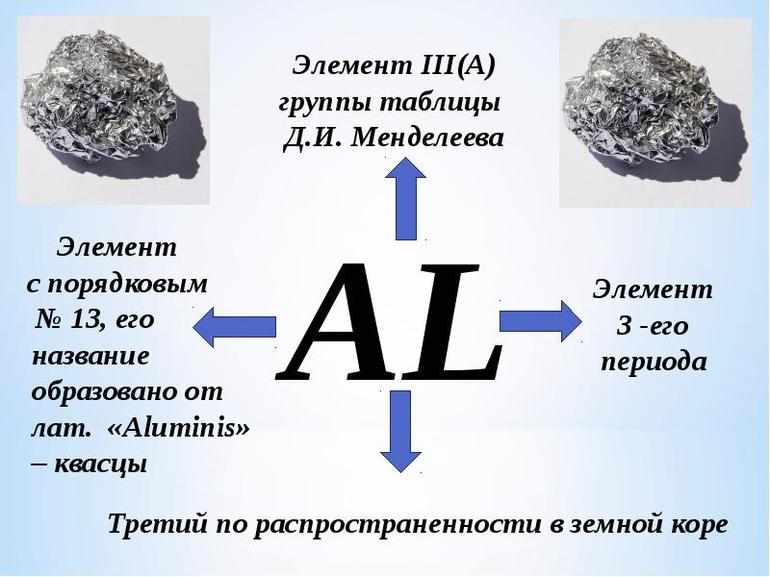
Алюминий можно найти в таблице Менделеева в третьей группе главной подгруппы. Распределение зарядов по орбитали описывается как 1s22s22p63s23p1. Алюминий в периодической таблице имеет тринадцатый номер, так как атом элемента состоит из тринадцати электронов. В электронной конфигурации сумма верхних индексов как раз и составляет это число: 2+2+6+2+1 =13.
Другими словами, верхние индексы показывают количество заряда, распределённого по слоям и орбиталям. Если изобразить схему строения электронной оболочки атома алюминия, можно отметить, что последним заполняемым слоем будет р-орбиталь. А это значит, что вещество принадлежит семейству р-элементов.
Алюминий расположился в третьем периоде. Это значит, что у него 3 электронных слоя. На первом находится s-орбиталь, 3 орбитали расположились на p-слое, и 5 на d-орбитали. На 3d-орбитали пусто, на неё электронов не хватило. На каждом слое не может быть более двух электронов. Заполняются же орбиты, начиная со слоев с меньшей энергией. Теоретически существует возможность возбужденного состояния для атома элемента за счет существования свободной 3d-орбитали. Однако распаривания ионов 3s-подуровня на практике не происходит.
Сначала электроны размещаются в первом слое, потом во втором, а уже затем в третьем. Орбитали каждого слоя заполняются с использованием принципа меньшей энергии. Так, сначала закрывается s-орбиталь, затем каждой орбитали достаётся по одному электрону, а затем по второму. Если их хватает, заполняются оставшиеся внешние р-орбитали.
В атоме алюминия полностью заполняются орбитали первых двух электронных слоев. На первом размещается 2 электрона, а на втором 8 носителей заряда. Два размещаются на s-орбиталь и по 2 на 3 р-орбитали. На третий слой переместятся 3 электрона: 13 — 8 — 2 = 3.